Opšte informacije
Home » Farmakovigilanca » Opšte informacije
Farmakovigilanca je skup aktivnosti vezanih za prikupljanje, otkrivanje, procjenu, razumijevanje, prevenciju i reagovanje na neželjena dejstva ljekova, kao i druge probleme vezane za njihovu primjenu. Neželjeno dejstvo lijeka podrazumijeva štetni i nenamjerno izazvani efekat lijeka, dok neželjeni događaj predstavlja neželjeno iskustvo nastalo u periodu primjene lijeka za koje uzročno-posljedična veza sa primjenom lijeka ne mora da bude dokazana i predstavlja bilo koji nenamjeravani i neželjeni znak (npr. abnormalni laboratorijski nalaz, simptom ili bolest), vremenski povezan sa primjenom lijeka.
Neočekivano neželjeno dejstvo lijeka je svako neželjeno dejstvo koje nije navedeno u odobrenom sažetku osnovnih karakteristika lijeka. Ozbiljno neželjeno dejstvo lijeka je ono koje ima za posljedicu smrt, neposrednu životnu ugroženost, bolničko liječenje, odnosno produžetak bolničkog liječenja ako za tim nije bilo potrebe prije upotrebe lijeka, trajno ili značajno oštećenje ili nesposobnost, kongenitalne anomalije ili poremećaje tokom dojenja, kao i drugo medicinski značajno stanje.
Sistem farmakovigilance je sistem koji uspostavljaju nosilac dozvole za lijek i Institut, u cilju praćenja bezbjednosti ljekova u prometu i detekcije svake promjene u odnosu koristi i rizika njihove primjene. Odnos koristi i rizika predstavlja procjenu pozitivnih terapijskih efekata lijeka s obzirom na rizik vezan za njegovu primjenu.
Razvoj i kontinuirano unapređenje sistema farmakovigilance su neophodni jer se u periodu prije stavljanja lijeka u promet ne mogu predvidjeti sva neželjena dejstva lijeka koja se mogu ispoljiti nakon što se lijek nađe u prometu. Razlozi za to su sljedeći:
1. Ispitivanja na životinjama ne mogu u potpunosti predvidjeti bezbjednost primjene lijeka kod ljudi
2. Ispitanici koji učestvuju u kliničkim ispitivanjima su odabrani, uslovi za primjenu lijeka u kliničkim ispitivanjima drugačiji su od onih u uobičajenoj kliničkoj praksi, trajanje kliničkog ispitivanja je ograničeno, a obuhvata i relativno mali broj ispitanika
3. S obzirom da je prije stavljanja lijeka u promet uglavnom manje od 5000 pacijenata podvrgnuto ispitivanom lijeku, moguće je uočiti jedino neželjena dejstva koja se često ispoljavaju
4. Najmanje 30 000 pacijenata mora uzeti lijek, da bismo bili sigurni da nijesmo propustili da uočimo neželjeno dejstvo čija je učestalost ispoljavanja veoma rijetka (neželjeno dejstvo koje se javlja kod najviše 1 na 10 000 pacijenata)
5. Podaci o rijetkim neželjenim dejstvima, toksičnom djelovanju nakon dugotrajne upotrebe lijeka, upotrebi u posebnim grupama pacijenata (poput djece, starijih osoba i trudnica) ili o interakcijama ljekova su nepotpuni ili nijesu dostupni.
Postmarketinško praćenje bezbjednosti primjene lijeka je od posebne važnosti za uočavanje ozbiljnih neželjenih dejstava koja su niske učestalosti ispoljavanja i neželjenih dejstava koja se ispoljavaju nakon dugotrajne primjene lijeka, ili poslije dužeg vremenskog perioda.
Informacije koje dobijamo iz postmarketinškog perioda životnog ciklusa lijeka (spontano prijavljivanje, klinička ispitivanja, relevantna literatura, naučni časopisi, registri i dr.) omogućavaju da steknemo pravu sliku bezbjednosnog profila određenog lijeka.
Na osnovu prikupljenih informacija o bezbjednosti primjene lijeka, koje se analiziraju i procjenjuju, Institut u cilju očuvanja javnog zdravlja može donijeti određene regulatorne mjere, koje su definisane Zakonom o ljekovima Crne Gore.
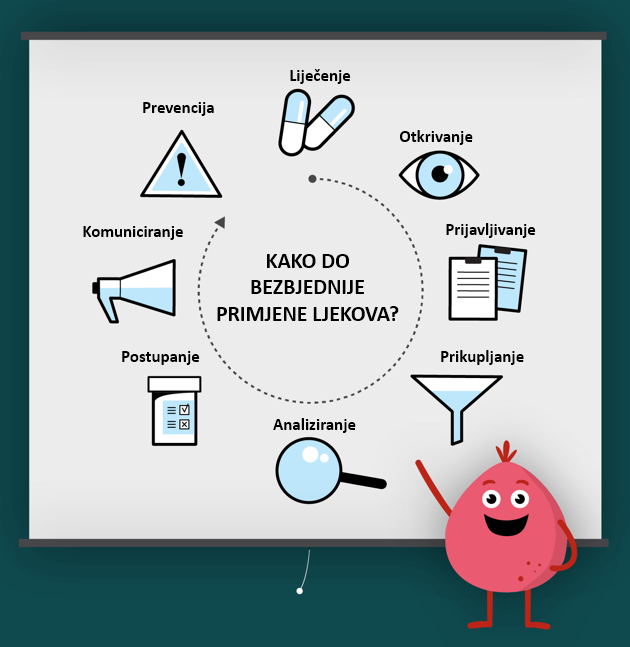
Više o farmakovigilanci i aktivnostima CInMED-a u cilju promocije ove naučne discipline, možete naći u dijelu Publikacije i na YouTube kanalu CInMED.
Pretraga registara
Ovdje možete pretražiti sve registre

Prijavite se za
Newsletter









