Obavještavaju se nosioci dozvola za lijek da je na portalu Instituta za ljekove i medicinska sredstva (CInMED) objavljen ažuriran obrazac zahtjeva za prijavu/odobrenje varijacije, u dijelu koji se odnosi na prijavu varijacija koje su lokalnog administrativnog karaktera (izmjene pakovanja, EAN koda i sl.).
Obavještavamo vas da je Godišnji izvještaj o prijavljenim neželjenim dejstvima ljekova za 2023. godinu objavljen na portalu Instituta u dijelu Farmakovigilanca/Godišnji izvještaji.
U okviru objavljenog izvještaja možete naći analizu prijava sumnje na neželjeno dejstvo lijeka koje su dostavljene Institutu za ljekove i medicinska sredstva (CInMED) u toku 2023. godine, kratak pregled najznačajnijih regulatornih mjera koje je CInMED sproveo u toku prethodne godine kao i informacije o edukativnim aktivnostima koje su realizovane u cilju razvoja sistema farmakovigilance u Crnoj Gori.
Usljed većeg angažovanja zdravstvenih radnika u sistemu nadzora nad primjenom ljekova, u 2023. godini je zabilježen značajan porast ukupnog broja dostavljenih prijava sumnje na neželjeno dejstvo lijeka u odnosu na prethodnu godinu. Veći broj prijavljenih neželjenih dejstava je prvenstveno rezultat projekta SMART farmaceut – Proces upravljanja terapijom, koji je započet u septembru 2023. godine, u organizaciji CInMED. Projekat SMART farmaceut je imao za cilj edukaciju i unapređenje kompetencija farmaceuta kao najdostupnijih zdravstvenih radnika, a većinu prijava sumnje na neželjeno dejstvo lijeka u toku 2023. godine su dostavili upravo farmaceuti koji su bili učesnici ovog projekta. Najveći broj dostavljenih prijava se odnosio na ljekove koji djeluju na kardiovaskularni sistem, što je očekivano imajući u vidu da se ova grupa ljekova najčešće koristi u Crnoj Gori. Kada je riječ o neželjenim reakcijama, najveći broj prijavljenih reakcija se odnosio na poremećaje sistema za varenje i reakcije na koži u vidu osipa i crvenila. Tim povodom, CInMED podsjeća zdravstvene radnike i pacijente da je u toku ljetnjih mjeseci potrebno obratiti posebnu pažnju na činjenicu da mnogi ljekovi (antibiotici, diuretici, ljekovi za ublažavanje bolova, retinoidi…) mogu povećati osjetljivost kože na UV zrake i izazvati reakcije fotosenzitivnosti. Prilikom propisivanja i izdavanja ovih ljekova potrebno je upozoriti pacijente da pročitaju Uputstvo za lijek, kao i da preduzmu neophodne mjere zaštite kože od UV zraka, kako bi se reakcije fotosenzitivnosti spriječile.
CInMED zahvaljuje svim zdravstvenim radnicima i pacijentima koji prijavljivanjem sumnje na neželjeno dejstvo lijeka učestvuju u nadzoru nad bezbjednom primjenom ljekova u Crnoj Gori.
Povodom obilježavanja 15 godina postojanja, Institut za ljekove i medicinska sredstva Crne Gore (CInMED) je odlučio da vrijednu donaciju usmjeri ka još jednom lijepom cilju za dobrobit naših građana, čime je još jednom potvrđena njegova posvećenost društvenoj odgovornosti.
Ovog puta je doprinos CInMED-a zajednici dat u vidu priznanja prirodi kao izvoru zdravlja i blagostanja. Kroz uspješnu saradnju sa „Zelenilom“ Podgorica i Glavnim gradom, izgrađen je dječiji park u Bloku 6, na uglu Ulice Meše Selimovića i Bulevara Mihaila Lalića, koji će biti oaza radosti i igre za naše najmlađe sugrađane, a ujedno i simbol važnosti očuvanja prirode i promocije zdravijeg načina života.
„U našem pozivu zdravlje je apsolutni prioritet, ali zdravlje ne može biti potpuno bez harmonije sa prirodom. Stoga danas ispisujemo jedan novi recept u kojem kao univerzalni lijek propisujemo drvo kao simbol zdravog okruženja koje nas hrani, liječi i inspiriše“, kazala je direktorica CInMED-a, doc. dr Snežana Mugoša.
Otvaranju dječijeg parka prisustvovali su predstavnici CInMED-a, na čelu sa direktoricom doc. dr Snežanom Mugošom, „Zelenila“ Podgorica, na čelu sa direktorom Petrom Krivokapićem, zamjenik gradonačelnice Podgorice Luka Rakčević, kao i mnogobrojni građani.
„CInMED će ostati predan humanitarnom djelovanju, a ovaj poduhvat je samo jedan u nizu naših napora da inspirišemo druge da slijede naš primjer u pružanju podrške zajednici i ostvarivanju pozitivnih promjena koje će služiti na čast kako našoj, tako i budućim generacijama“, istakla je doc. dr Snežana Mugoša.
Veliko nam je zadovoljstvo da objavimo da je Laboratoriji Instituta za ljekove i medicinska sredstva Crne Gore od strane Akreditacionog tijela Crne Gore dodijeljen sertifikat o akreditaciji prema zahtjevima standarda MEST ISO/IEC 17025:2018 – Opšti zahtjevi za kompetentnost laboratorija za ispitivanje i laboratorija za etaloniranje.
Glavni cilj naše Laboratorije je zaštita crnogorskog tržišta i građana od prisustva falsifikovanih i substandardnih ljekova, kao i unapređenje naučno-istraživačkog rada Instituta, koji je nastavna baza Univerziteta Crne Gore.
Institut u kontinuitetu predano radi na unapređenju kvaliteta poslovanja i primjeni međunarodnih i evropskih standarda. Od osnivanja Laboratorije kao organizacione jedinice 2021. godine, Institut je veliku pažnju posvetio uspostavljanju sistema rada u skladu sa zahtjevima standarda koji se odnose na sistem kvaliteta laboratorija za ispitivanje.
Laboratorijske metode koje se sprovode u cilju detekcije falsifikovanih i substandardnih ljekova a koje su obuhvaćene obimom akreditacije su: 1. Određivanje ujednačenosti mase jednodoznog preparata 2. Komparacija difraktograma snimljenih uzoraka sa difraktogramima iz referentne baze podataka 3. Identifikacija kristalnih faza u uzorcima čvrstih formi ljekova i suplemenata putem difrakcije X-zraka.
Vjerujemo da ćemo dosljednom primjenom usvojenih standarda i stalnim unapređenjem procesa rada i kompetentnosti naših eksperata pružiti značajan doprinos zaštiti građana Crne Gore od falsifikovanih i substandardnih ljekova i suplemenata.
Institut za ljekove i medicinska sredstva (CInMED) obavještava javnost da neće po uobičajenom planu objaviti izvještaj o potrošnji ljekova za 2023. godinu. Razlog je nedostatak zvaničnih podataka o procijenjenom broju stanovnika po opštinama sredinom godine, koji svake godine preuzimamo od Zavoda za statistiku Crne Gore (MONSTAT). S obzirom na okolnosti u vezi sa popisom stanovništva koji je okončan krajem 2023. godine, dužni smo da sačekamo zvanične podatke MONSTAT-a kako bismo osigurali najviši stepen preciznosti u našem izvještaju.
Obavještavaju se podnosioci zahtjeva da je na portalu Instituta za ljekove i medicinska sredstva (CInMED) objavljeno ažurirano uputstvo Način podnošenja zahtjeva i dokumentacije za obnovu dozvole za stavljanje lijeka za humanu upotrebu u promet. Molimo sve podnosioce zahtjeva da se prilikom pripreme i predaje dokumentacije pridržavaju ažuriranog uputstva.
Institut za ljekove i medicinska sredstva (CInMED) obavještava javnost da je dozvola za stavljanje u promet vakcine protiv COVID-19 pod nazivom Vaxzevria, proizvođača AstraZeneca u Crnoj Gori prestala da važi na zahtjev nosioca dozvole. Nosilac dozvole u Evropskoj uniji je takođe povukao dozvolu za lijek, tako da navedena vakcina više nije registrovana ni u zemljama EU.
Prestanak važenja dozvole za lijek je rezultat činjenice da više ne postoje komercijalni interesi za prometovanje ove vakcine u Crnoj Gori, a iz istih razloga je dozvola za lijek povučena i u Evropskoj uniji. Podaci o kvalitetu, bezbjednosti i efikasnosti ove vakcine nijesu bili razlog za povlačenje dozvole, već su u međuvremenu razvijene i odobrene nove vakcine koje su prilagođene novim sojevima virusa SARS-CoV-2, te je prema tome prestala da postoji potreba za daljom primjenom vakcine Vaxzevria.
Iako je dozvola za vakcinu Vaxzevria bila važeća u prethodnom periodu u Crnoj Gori, poslednji zahtjev za uvoz navedene vakcine je od strane CInMED odobren u maju 2021. godine. Nakon toga nije podnesen nijedan novi zahtjev za uvoz, tako da navedena vakcina nije u prometu u Crnoj Gori.
Obavještenje o Trećoj godišnjoj konferenciji CInMED-A

Poštovani i dragi saradnici i prijatelji,
Sa izuzetnim zadovoljstvom najavljujemo treću godišnju konferenciju Instituta za ljekove i medicinska sredstva Crne Gore kojom ćemo ujedno obilježiti 15 godina postojanja Instituta. Ovaj posebni jubilej nije samo prilika za slavlje, već i poziv da se osvrnemo na put koji smo prošli, na dosegnute visine i izazove koji su nas oblikovali. Ovo je i poziv na budućnost, na dalje istraživanje, učenje i rast.
U periodu od 28. do 30. novembra, hotel Avala u Budvi postaće epicentar stručnih razgovora, inovativnih ideja i dubokih uvida, okupljajući stručnjake iz različitih područja. Kroz bogat program, osvijetlićemo puteve koje smo prošli i one koje tek treba da istražimo. Očekujte inspirativna predavanja i predavače, interaktivne radionice i panel diskusije koje će vas podstaknuti na razmišljanje i akciju.
U narednom periodu očekujte obavještenja sa svim detaljima.
Pozivamo vas da budete dio ovog velikog jubileja i neka naša stručnost i znanje budu u službi zdravlja, a naša zajednička predanost most prema boljoj budućnosti za sve nas.
Preliminarni program dostupan je ovdje
Vidimo se na konferenciji!
Poštovani i dragi saradnici,
Sa zadovoljstvom vas obavještavamo da će u organizaciji Instituta za ljekove i medicinska sredstva (CInMED) biti sprovedena edukacija pod nazivom Kontrola sistema farmakovigilance – Navigacija kroz GVP smjernice. Edukacija će se održati 25.04.2024. godine u hotelu CUE u Podgorici.
Predavači na edukaciji biće mr pharm. Ivan Meštrović, inspektor za farmakovigilancu sa velikim iskustvom iz Agencije za lijekove i medicinske proizvode Republike Hrvatske, kao i dr pharm. Slađana Marsenić, rukovoditeljka Inspektorata CInMED-a i mr pharm. Veselinka Vukićević, rukovoditeljka Odjeljenja za farmakovigilancu CInMED-a.
Ova edukacija je od suštinskog značaja za lica odgovorna za farmakovigilancu s obzirom na planirano započinjanje inspekcija u ovoj oblasti tokom ove godine. Kroz ovaj događaj dobićete jedinstvenu priliku da se detaljno upoznate sa zahtjevima GVP-a i pripremite za nadolazeće nadzore. Napominjemo da je ovo jedina planirana edukacija u ovoj oblasti u ovoj godini.
U skladu sa Odlukom o načinu plaćanja i visini naknada za obavljanje zakonom utvrđenih nadležnosti Instituta za ljekove i medicinska sredstva, visina troškova za poludnevnu edukaciju iznosi 300,00 eura po osobi.
Rok za prijavu je 08.04.2024. godine, a prijave možete poslati na e-mail adresu: [email protected].
O svim ostalim detaljima, uključujući plan i program, bićete blagovremeno obaviješteni.
Obavještavamo nosioce dozvola za stavljanje lijeka u promet i nosioce dozvola za promet ljekova na veliko, da je 7.3.2024. godine, u Službenom listu objavljena izmjena Uredbe o kriterijumima za formiranje maksimalnih cijena ljekova („Službeni list CG“, br. 130/21 i 9/22).
Prethodne utvrđene maksimalne cijene ljekova je neophodno uskladiti zbog promjene referentnih zemalja, kao i cijena ljekova u referentnim zemljama.
Zahtjeve za formiranje/usklađivanje maksimalnih cijena ljekova, sa dokumentacijom CInMED će početi da prima od 15.3.2024. godine, kada Uredba i stupa na snagu. Uz zahtjev dostaviti dokumentaciju u skladu sa Uputstvom za formiranje maksimalne cijene lijeka, koje možete pronaći u dijelu portala Humani Ljekovi/Maksimalne cijene ljekova/Uputstva odnosno ovdje.
Rok za dostavljanje dokumentacije je 90 dana.
Na portalu CInMED u dijelu Regulativa / Ljekovi / Humani ljekovi, objavljen je Pravilnik o bližim uslovima za izdavanje saglasnosti za uvoz lijeka koji nema dozvolu za lijek („Službeni list CG“, br. 19/24 od 05.03.2024.), koji stupa na snagu 13.03.2024. godine.
Na osnovu preporuka Evropske agencije za ljekove (EMA) nosioci dozvole za ljekove koji sadrže pseudoefedrin su, u saradnji sa Institutom za ljekove i medicinska sredstva, informisali zdravstvene radnike o riziku od sindroma posteriorne reverzibilne encefalopatije (PRES) i sindroma reverzibilne cerebralne vazokonstrikcije (RCVS) u vezi sa primjenom ljekova koji sadrže pseudoefedrin. U Crnoj Gori je u prometu više ljekova različitih proizvođača koji sadrže pseudoefedrin u kombinaciji sa drugim aktivnim supstancama, a njihova primjena je odobrena za liječenje simptoma prehlade i gripa ili alergijskog rinitisa. Ove ljekove ubuduće ne treba da koriste pacijenti sa teškom ili nekontrolisanom hipertenzijom, kao ni pacijenti sa teškim oboljenjem bubrega, jer ta stanja povećavaju rizik za pojavu navedenih sindroma. Simptomi PRES i RCVS uključuju iznenadnu jaku glavobolju, mučninu, povraćanje, konfuziju, epi napade ili poremećaje vida. Nakon prestanka primjene ljekova koji sadrže pseudoefedrin i primjene odgovarajuće terapije, navedeni simptomi se povlače. Slučajevi PRES i RCVS nijesu prijavljeni u Crnoj Gori.
Tekst pisma koje je ovim povodom upućeno zdravstvenim radnicima možete naći ovdje.
Povodom predstojećih novogodišnjih i božićnih praznika, a u skladu sa saopštenjem izdatim od strane Ministarstva rada i socijalnog staranja, obavještavamo sve zainteresovane strane da Institut neće raditi sa strankama 1, 2. i 8. januara 2024. godine.
Povodom Njegoševog dana, crnogorskog praznika kulture, a u skladu sa saopštenjem izdatim od strane Ministarstva rada i socijalnog staranja, obavještavamo sve zainteresovane strane da Institut neće raditi sa strankama 13. i 14. novembra 2023. godine.
Članom 9 tačka 51 Zakona o medicinskim sredstvima, proizvođač medicinskog sredstva je definisan kao pravno ili fizičko lice odgovorno za njegov dizajn, proizvodnju, pakovanje i obilježavanje prije nego što ga stavi u promet pod svojim imenom, bez obzira na to da li je ove aktivnosti izvršio samostalno ili ih je u njegovo ime izvršilo drugo lice.
Shodno tome, proizvođač je lice koje samostalno ili putem ugovorne proizvodnje proizvodi medicinsko sredstvo, stavlja ga na tržište pod svojim imenom i posjeduje sva prava i obaveze koja se tiču proizvodnje proizvoda iz svog proizvodnog asortimana.
Dakle, shodno važećoj regulativi došlo je do izmjena u postupku registracije proizvođača koji nemaju sjedište/boravak/prebivalište u Crnoj Gori, te se s toga ne može smatrati da je fizičko ili pravno lice koje proizvodi medicinska sredstva pod svojim imenom, proizvodno mjesto određenog proizvođača, već se radi o proizvođaču.
Okolnost da jedno lice koje je proizvođač posluje pod nekim drugim licem ili korporacijom kao i njihovi korporativni odnosi, nisu relevantni za postupak registracije u smislu gore navedene zakonske definicije proizvođača i razlike u odnosu na proizvodno mjesto.
U vezi sa gore navedenim, podsjećamo da je članom 140 Zakona o medicinskim sredstvima (“Službeni list CG”, broj 24/19) propisano da su pravna lica koja proizvode medicinska sredstva i koja vrše promet medicinskih sredstava na veliko i medicinskih sredstava na malo, dužna da svoje poslovanje i aktivnosti usklade sa ovim zakonom, u roku od 24 mjeseca od dana stupanja na snagu ovog zakona.
Shodno odredbama Zakona o medicinskim sredstvima, kao nosioci registracije dužni ste da podnesete zahtjev za izmjenu prethodno izdatih rješenja, odnosno usaglašavanje sa Zakonom o medicinskim sredstvima, kako bi svi koji su u rješenjima navedeni kao proizvodna mjesta, a imaju svojstva iz člana 9 začka 51 Zakona o medicinskim sredstvima, bili i registrovani kao proizvođači, u skladu sa zakonom, u koji su transportovane važeće evropske regulative koje proizvođaču daju sva prava prilikom odlučivanja, odnosno odabira sopstvenog ovlašćenog predstavnika za određenu teritoriju.
Imajući u vidu da je prelazni period za usaglašavanje iz člana 140 Zakona o medicinskim sredstvima istekao, a da postoji određeni boj neusaglašenih rješenja o registraciji proizvođača koji nemaju sjedište/boravak/prebivalište u Crnoj Gori, Institut za ljekove i medicinska sredstva produžiće rok. U tom smislu, potrebno je da rješenja o registraciji proizvođača koji nemaju sjedište/boravak/prebivalište u Crnoj Gori uskladite (podnošenjem zahtjeva za registraciju, odnosno zahtjeva za izmjenu registracije) u roku od 3 mjeseca od dana dostavljanja ovog obavještenja a najkasnije do 06.02.2024. godine.
Takođe, napominjemo da ukoliko se ne odradi potrebno usklađivanje pomenutih rješenja, Institut će po službenoj dužnosti pokrenuti postupak brisanja proizvođača, u skladu sa članom 59 stav 1 tačka 2 Zakona o medicinskim sredstvima.
Institut za ljekove i medicinska sredstva Vam stoji na raspolaganju za dalju saradnju.
Počinje osmi po redu #MedSafetyWeek! I ove godine zajedno sa više od 80 zemalja širom svijeta, Institut za ljekove i medicinska sredstva (CInMED) učestvuje u kampanji koja se putem društvenih mreža sprovodi pod vođstvom Kolaborativnog centra Svjetske zdravstvene organizacije za internacionalno praćenje bezbjednosti primjene ljekova – Uppsala Monitoring Centre (UMC). Kampanja se održava u sedmici od 6. do 12. novembra 2023. godine, sa ciljem da ukaže na važnu ulogu pacijenata i zdravstvenih radnika u bezbjednoj primjeni ljekova.
Tema ovogodišnje kampanje je ,,Ko može prijaviti sumnju na neželjeno dejstvo lijeka?“. Ljekovi su bezbjedni i efikasni, ali mogu kod određenih pacijenata izazvati neželjene reakcije. Nadležne regulatorne institucije u oblasti ljekova, u Crnoj Gori CInMED, uspostavljaju sistem za kontinuirano praćenje bezbjednosti ljekova, u cilju prikupljanja novih informacija o već poznatim neželjenim reakcijama i blagovremenog otkrivanja novih.
Sistem prijavljivanja neželjenih reakcija na ljekove detektuje, prikuplja i analizira prijave sumnji na neželjene reakcije, u cilju prevencije njihovog ispoljavanja kad god je to moguće.
Svaka prijava dostavljena od strane pacijenta ili zdravstvenog radnika je važna jer doprinosi stvaranju prave slike o bezbjednosti i efikasnosti lijeka. Kada je potrebno, u cilju zaštite pacijenata, CInMED sprovodi adekvatne regulatorne mjere koje mogu doprinijeti unapređenju propisivačke prakse i boljim ishodima liječenja.
Nadamo se da će ova kampanja ohrabriti zdravstvene radnike i pacijente da prijave sumnju na neželjene reakcije u vezi sa primjenom ljekova, jer se na taj način uvećava znanje o ljekovima, što ih čini bezbjednijim za sve nas.
Pozivamo Vas da pogledate raznovrsne edukativne materijale koji prate kampanju #MedSafetyWeek, a koji će tokom sedmice biti objavljivani na društvenim mrežama CInMED kao i zvaničnom CInMED YouTube nalogu.
Više o načinima prijavljivanja sumnje na neželjeno dejstvo lijeka možete naći u dijelu Farmakovigilanca/Prijava neželjenog dejstva lijeka.
Na poziv Agencije za ljekove i medicinska sredstva Španije, zamjenica direktora Instituta za ljekove i medicinska sredstva, mr Mira Kontić i rukovoditeljka Odjeljenja za uvoz/izvoz Instituta, dr sc. pharm Tijana Mićović, prisustvuju 60. sastanku EMACOLEX-a, radnog tijela Evropske agencije za ljekove o pravnim pitanjima, koji se održava od 2. do 3. novembra u Madridu, Španija.
Prisustvo 60. EMACOLEX sastanku izuzetna je prilika za razmjenu ideja i iskustava u vezi sa pravnim pitanjima od nacionalnog značaja, te aktuelnim temama u oblasti zdravstvenih sistema zemalja Evrope. Ovaj sastanak ujedno omogućava širenje perspektive u vezi sa oblikovanjem regulatornih okvira na tržištu ljekova i medicinskih sredstava, doprinoseći tako unapređenju sistema u ovoj oblasti.

Učestvovanje u aktivnostima najvažnijeg pravnog tijela Evropske unije (EU) od izuzetnog je značaja za Institut, kao i za Crnu Goru, budući da obezbjeđuje pristup informacijama o najnovijim pravnim promjenama i inicijativama u vezi sa ljekovima i medicinskim sredstvima u okviru EU, te predstavlja priliku za jačanje saradnje između različitih zemalja i organizacija u cilju unapređenja kvaliteta, bezbjednosti i efikasnosti ljekova i medicinskih sredstava.
Razmjena iskustava i saradnja igraju ključnu ulogu u pronalaženju rješenja za brojne probleme sa kojima se suočavamo. Kroz dijalog sa evropskim tijelima, stvaramo mogućnost za uzajamno učenje i razmjenu najboljih praksi. Ovaj pristup omogućava nam da sagledamo različite pristupe i efikasno prevaziđemo izazove. U svijetlu ovih ciljeva, Institut se zalaže za nastavak angažmana i saradnje kako bi doprinio izgradnji bolje budućnosti za zdravstveni sistem Crne Gore.
Institut za ljekove i medicinska sredstva primio je obavještenje o pojavi falsifikovanog lijeka Ozempic 1 mg, čiji nosilac dozvole je kompanija Novo Nordisk A/S, na tržištu Evropske unije (EU). Slučajevi falsifikata su zabilježeni u pojedinim veleprodajama ljekova u EU i Ujedinjenom Kraljevstvu. Pakovanja ovih falsifikovanih ljekova su označena na njemačkom jeziku i potiču iz veleprodaja u Austriji i Njemačkoj.
Spoljašnje pakovanje falsifikovanog lijeka identično je originalnom pakovanju, ali falsifikati se mogu prepoznati po unutrašnjem pakovanju. Na slikama u nastavku možete se vidjeti izgled injekcionog pena originalnog lijeka namijenjenog njemačkom tržištu i izgled injekcionog pena lažnog lijeka, koje je objavila Agencija za ljekove Njemačka. Injekcioni pen lažnog lijeka može imati i drugačiji izgled u odnosu na prikazani.
Originalni lijek:
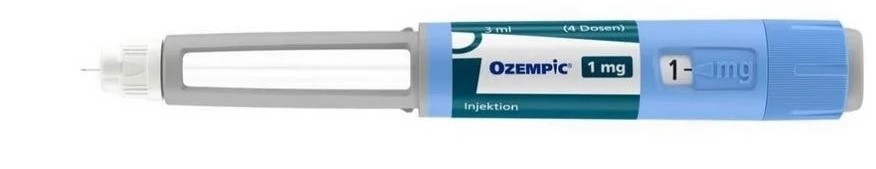
Falsifikovani lijek:

Lijek Ozempic (semaglutid) registrovan je, odnosno ima dozvolu za stavljanje u promet u Crnoj Gori, koja je na snazi od januara 2022. godine. Međutim, budući da lijek nije bio u prometu u Crnoj Gori, samim tim nije ni zabilježena prijava o distribuciji falsifikovanog lijeka.
Uprkos tome, želimo da skrenemo pažnju svim relevantnim akterima, uključujući veleprodaje, zdravstvene radnike i pacijente, na važnost kontinuirane pažnje i opreza u vezi sa bezbjednošću ljekova. Iako slučajevi pojave falsifikovanih ljekova u legalnom lancu snabdijevanja nijesu zabilježeni na našem tržištu, svjesni smo da je globalna priroda tržišta ljekova takva da izazovi mogu nastati u bilo kojem trenutku. Stoga, ovu priliku koristimo da podsjetimo na važnost praćenja i primjenjivanja najviših standarda u prometu ljekova u svrhu obezbjeđivanja ljekova odgovarajućeg kvaliteta, bezbjednosti i efikasnosti za građane u Crnoj Gori.
Institut za ljekove i medicinska sredstva (CInMED) sa ponosom objavljuje da je postao pridruženi član Međunarodnog foruma regulatora medicinskih sredstava (International Medical Devices Regulators Forum, IMDRF). Za CInMED, kao crnogorski regulatorni autoritet za medicinska sredstva, ovaj korak je od izuzetnog značaja za dalji razvoj i unapređenje regulatornog okvira, i imaće dalekosežne implikacije za crnogorsku industriju, globalnu međunarodnu poziciju i procese evropskih integracija.
Samo šest mjeseci nakon zvaničnog poziva predsjedavajućeg IMDRF, dr. Andrzej Rysa, da CInMED postane član porodice međunarodnih regulatora na polju medicinskih sredstava, Crna Gora se ponosno ističe kao jedina zemlja u regionu koja je ostvarila ovaj zapažen uspjeh, a nije članica Evropske unije (EU).
Zvaničnom 24. sastanku IMDRF održanom krajem prošlog mjeseca u Berlinu prisustvovali su na poziv Evropske komisije predstavnici CInMED-a, mr Mira Kontić, zamjenica direktora, i dr Uroš Labudović, rukovodilac Centra za medicinska sredstva. Tom prilikom predstavljen je CInMED kao nadležno regulatorno tijelo Crne Gore u ovoj oblasti, te perspektiva CInMED-a i prednosti našeg tržišta, kao i zvanična aplikacija za postizanje statusa pridruženog člana (affiliate membership) u IMDRF.
IMDRF je renomirana međunarodna organizacija koja okuplja regulatore i stručnjake iz oblasti medicinskih sredstava iz različitih djelova svijeta. Njen glavni cilj je unapređenje globalne harmonizacije regulatornih pristupa za medicinska sredstva. Članstvo u IMDRF pruža mogućnost razmjene znanja, iskustava i najboljih praksi između članica. Time se stvara okruženje koje podstiče inovacije i obezbjeđuje sigurnost i efikasnost medicinskih sredstava, i stvara jak i jedinstven regulatorni okvir uz promociju efikasnih modela za odgovor na rastuće izazove u zaštiti javnog zdravlja i bezbjednosti pacijenata.
Članice ove međunarodne organizacije su i najuticajniji evropski i svjetski regulatori, kao što su agencije za ljekove SAD, Brazila, Kanade, Velike Britanije, Japana, Kine, Australije itd.

Za CInMED, postati pridruženi član IMDRF predstavlja prepoznavanje visokih standarda kvaliteta i profesionalizma koji su uspostavljeni u radu crnogorskog regulatornog tijela. Ovo članstvo otvara vrata široj saradnji sa drugim regulatornim tijelima i stručnjacima širom svijeta, omogućavajući pristup najnovijim informacijama i smjernicama u oblasti medicinskih sredstava.
Pristup globalnim standardima i smjernicama za razvoj i plasman medicinskih sredstava će ojačati konkurentske pozicije crnogorskih kompanija na međunarodnom tržištu i doprinijeti ekonomskom rastu zemlje.
Pored toga, članstvo u IMDRF predstavlja i značajan korak ka ostvarivanju ciljeva pristupanja Crne Gore EU, imajući u vidu da je prihvatanje globalno harmonizovanih standarda i pravila u oblasti medicinskih sredstava ključno za usklađivanje sa zahtjevima EU i olakšava i ubrzava proces pristupanja EU.
Ovaj korak prema članstvu u IMDRF predstavlja veliku čast i obavezu za CInMED, ali i priznanje za dosadašnje napore i posvećenost.
Status koji je CInMED stekao ovim putem otvara nam vrata ka mnogim prednostima unutar ove organizacije, gdje je posebno važno istaći pristup prilikama za stručno usavršavanje, najnovijim trendovima i inovacijama, kao i osnaživanje naše pozicije za članstvo u EU. Dostignuća na polju medicinskih sredstava, odnosno uvođenje izuzetno sofisticiranih novih tehnologija u liječenje najkompleksnijih oboljenja zaista pomjera granice konvencionalne medicine. Stoga moramo širiti svoje vidike i biti spremni za budućnost koju sa sobom donosi naučno-tehnološki razvoj, ali i uvoditi mjere koje obezbjeđuju najviši standard zaštite naših pacijenata.

Institut za ljekove i medicinska sredstva Crne Gore organizuje drugu godišnju konferenciju pod nazivom Sinergija regulative i nauke na evropskom putu u periodu od 14. do 16. decembra u hotelu Avala u Budvi.
Predavanja i diskusije će i ove godine biti organizovani shodno interesovanjima naših klijenata iskazanim u prethodnom periodu. U skladu sa tim, naš program će prevashodno biti usmjeren na teme koje se tiču postupka izdavanja dozvole za lijek, obnova i varijacija, zatim praćenja potrošnje ljekova i farmakovigilance. Pored toga, planirana je i naučna sesija koja predstavlja odraz naše posvećenosti istraživanju i razvoju u Institutu.
Detaljnije informacije dostupne su na stranici Druga godišnja konferencija CInMED-a.
Radujemo se Vašem učešću i zajedničkom putu stvaranja sinergije!
Predstavnici Instituta za ljekove i medicinska sredstva Crne Gore (CInMED), na čelu sa zamjenicom direktora Mr Mirom Kontić i rukovodiocem Laboratorije CInMED Mr Davidom Kočovićem, prisustvovali su završnoj konferenciji MEDI-THEFT projekta koju je organizovala Agencija za ljekove Italije (AIFA), kao koordinator projekta, 29. septembra.
Događaju su prisustvovali predstavnici evropskih regulatornih agencija i drugih nadležnih organa, predstavnici privatnog sektora i udruženja farmaceutske industrije.
Konferencija je pružila uvid u najnovije informacije o posebnim oblicima farmaceutskog kriminala – krađi i falsifikovanju ljekova i medicinskih sredstava. Pored toga, ova konferencija je bila prilika za predstavljanje impresivnih rezultata koji su postignuti i alata koji su uspješno razvijeni i implementirani u toku trajanja ovog dvogodišnjeg projekta koji se zvanično završava 31. oktobra.

Najvažniji segment događaja bio je posvećen prezentaciji projekta od strane AIFA-e i partnera MEDI-THEFT Konzorcijuma, među kojima je i CInMED. Mr Kočović je predstavio brojne i značajne aktivnosti koje je u prethodne dvije godine sproveo CInMED u okviru MEDI-THEFT projekta na polju širenja svijesti o potrebi sprovođenja aktivnosti i sistemskih rješenja kojima se sprečava ulazak kradenih i falsifikovanih ljekova i medicinskih sredstava u legalne lance snabdijevanja pacijenata.
Događaj je zaključen panel diskusijom posvećenom operativnim i strateškim aspektima buduće upotrebe MEDI-THEFT platforme i nastavka aktivnosti u borbi protiv kradenih i falsifikovanih ljekova zemalja partnera na projektu.
Ovaj projekat je samo jedan od mnogih koraka koje Institut preduzima i koje će nastaviti da preduzima u svrhu ostvarenja cilja zaštite dobrobiti pacijenata kroz unapređenje tržišta ljekova.

Zvanični 24. sastanak Međunarodnog foruma regulatora medicinskih sredstava (IMDRF), kojem su na poziv Evropske komisije prisustvovali predstavnici Instituta za ljekove i medicinska sredstva Crne Gore, mr Mira Kontić i dr Uroš Labudović, održan je u periodu 25-29. septembra u Berlinu. Učešće na ovakvom događaju od izuzetnog je značaja za međunarodnu poziciju Instituta i uspostavljanje snažnih veza sa drugim regulatorima u oblasti medicinskih sredstava.
Tokom prva dva dana sastanku su prisustvovali svi relevantni akteri u ovoj oblasti, uključujući predstavnike industrije i regulatornih tijela, u cilju predstavljanja inovacija u oblasti medicinskih sredstava. Zajednička razmjena najnovijih saznanja i iskustava najbolji je put za usklađivanje najboljih praksi, kao i promovisanje sigurnosti i efikasnosti medicinskih sredstava.

Mr Mira Kontić, zamjenica direktora, 27. septembra je na ovom prestižnom događaju predstavila Institut kao nadležno regulatorno tijelo Crne Gore u ovoj oblasti, te regulatorni okvir koji je na snazi, kao i perspektivu i prednosti našeg tržišta. To je bila izuzetna prilika da pokažemo našu posvećenost unapređenju sigurnosti i efikasnosti medicinskih sredstava u Crnoj Gori i iniciramo dalji razvoj industrije medicinskih sredstava u Crnoj Gori u cilju obezbjeđivanja najsavremenijih načina liječenja našim pacijentima.
Mr Kontić je 28. septembra takođe predstavila našu aplikaciju za postizanje statusa pridruženog člana (affiliate membership) u IMDRF. Ovaj status bi nam otvorio vrata ka mnogim prednostima unutar ove organizacije, gdje je posebno važno istaći pristup prilikama za stručno usavršavanje, najnovijim trendovima i inovacijama, kao i osnaživanje naše pozicije za članstvo u EU.
Institut dijeli viziju IMDRF-a o uspostavljanju usklađenog regulatornog okvira koji obezbjeđuje sigurnost pacijenata uz promociju inovacija. Aktivnim učešćem nastojimo doprinijeti stvaranju globalno harmonizovanih propisa koji olakšavaju pravovremeno uvođenje sigurnih i efikasnih medicinskih sredstava na tržište.
Institut za ljekove i medicinska sredstva (CInMED) ovim putem obavještava podnosioce zahtjeva da je na portalu CInMED u dijelu Humani ljekovi/ Izdavanje dozvole za lijek, objavljeno ažurirano uputstvo Način podnošenja zahtjeva i dokumentacije za obnovu dozvole za stavljanje lijeka za humanu upotrebu u promet, kao i obrasci zahtjeva Zahtjev za obnovu dozvole za stavljanje lijeka u promet i Propratno pismo – izdavanje obnove dozvole za lijek. Predmetno uputstvo sadrži informacije o načinu i vrsti dokumentacije koju je potrebno dostaviti CInMED uz zahtjev za obnovu dozvole za lijek, kao i druge informacije.
Obrasci zahtjeva i propratnog pisma su objavljeni i u dijelu Veterinarski ljekovi / Izdavanje dozvole za lijek.
Molimo sve podnosioce zahtjeva da se prilikom pripreme i predaje dokumentacije pridržavaju ažuriranog uputstva i koriste propisane obrasce.
Povodom Dana državnosti, a u skladu sa saopštenjem izdatim od strane Ministarstva rada i socijalnog staranja, obavještavamo sve zainteresovane strane da su 13. i 14. jul 2023. godine neradni dani i da Institut neće raditi sa strankama.
Obavještavamo vas da je Godišnji izvještaj o prijavljenim neželjenim dejstvima ljekova za 2022. godinu objavljen na portalu Instituta u dijelu Farmakovigilanca/Godišnji izvještaji.
U okviru objavljenog izvještaja možete naći analizu prijava sumnje na neželjeno dejstvo lijeka koje su dostavljene Institutu u toku 2022. godine, kao i kratak pregled najznačajnijih regulatornih mjera koje je CInMED sproveo u toku prethodne godine. Izvještaj sadrži i informacije o edukativnim aktivnostima koje su realizovane u cilju razvoja sistema farmakovigilance u Crnoj Gori.
Institut za ljekove i medicinska sredstva (CInMED) bio je učesnik jubilarne desete Medical konferencije pod nazivom „Aktuelnosti u zdravstvu, medicini i farmaciji“ koju tradicionalno organizuje časopis „Medical CG“. Konferencija je održana u periodu od 1. do 4. juna u Ulcinju.
Povodom obilježavanja decenije organizovanja Medical konferencije, uručene su zahvalnice za doprinos i podršku, te je tom prilikom zahvalnica uručena i direktorici CInMED-a, doc. dr Snežani Mugoši. Ona je u ime CInMED-a izrazila zahvalnost na uspješnoj dugogodišnjoj saradnji i prijateljstvu, te odala priznanje za neizmjeran trud, rad, kao i odgovoran i pažljiv odnos u cilju doprinosa razvoju zdravstvenog sistema, edukovanosti i svijesti zdravstvenih radnika, ali i građana.
„Naše dugotrajno i pouzdano partnerstvo počiva na dubokom razumijevanju i zajedničkim načelima solidarnosti i humanosti, budući da i naša institucija teži da bude primjer i predvodnik u društveno odgovornom poslovanju i dobročinstvu“, kazala je doc. dr Snežana Mugoša u svom obraćanju.
Prvog dana konferencije organizovan je okrugli sto sa ciljem diskusije o značaju revizije Liste ljekova, sa akcentom na uštede i veću dostupnost ljekova, zatim o izazovima u kontinuiranom snabdijevanju ljekovima i medicinskim sredstvima, te postupcima javnih nabavki, kao i o kriterijumima za vođenje pregovora i utvrđivanje cijena ljekova. U ime Instituta za ljekove i medicinska sredstva (CInMED), učesnica okruglog stola bila je direktorica CInMED-a, doc. dr Snežana Mugoša.
Ona je tom prilikom istakla rezultate CInMED-a u prethodnih godinu i po dana koji predstavljaju izvanredan temelj za uspješan doprinos CInMED-a u okviru navedenih oblasti od značaja za zdravstveni sistem Crne Gore, te naglasila značaj sinergijskog pristupa svih nadležnih institucija za postizanje izuzetnih rezultata, kako u ovim, tako i u ostalim segmentima javnog zdravlja.
Trećeg dana konferencije organizovana je sesija CInMED-a, kojoj je prisustvovao veliki broj učesnika i koja je probudila veliko interesovanje prisutnih. Moderator sesije bila je direktorica CInMED-a, doc. dr Snežana Mugoša.
U okviru sesije predstavljena je analiza potrošnje ljekova u periodu od 2017. do 2021. godine, a pored toga mr pharm. spec. Lidija Čizmović preliminarno je predstavila i podatke o potrošnji ljekova za prethodnu, 2022. godinu. Dr pharm. Anja Glušica govorila je o sličnostima i razlikama generičkih i originalnih ljekova, te ukazala na problem u pogledu znanja, percepcije i vjerovanja pacijenata, pa i zdravstvenih radnika, kada su u pitanju generički ljekovi. Na temu sistema referentnih cijena ljekova u EU govorila je gošća iz Hrvatske agencije za lijekove i medicinske proizvode, mr pharm. spec. Sanja Matić, pri čemu je opisala različite modele referentnih cijena u EU i istakla prednosti ovakve metodologije.
Četvrtog dana konferencije, izlaganje na temu biološki sličnih ljekova imala je mr pharm. spec. Maja Lisičić, gdje je posebno bilo riječi o regulatornim aspektima biološki sličnih ljekova i zamjenjivosti.
Obavještavamo vas da je Izvještaj o prometu ljekova u Crnoj Gori za 2022. godinu objavljen i nalazi se portalu Instituta u dijelu Humani ljekovi/Potrošnja ljekova.
U okviru objavljenog izvještaja možete naći podatke o ljekovima koji su se prometovali u 2022. godini, na svim nivoima ATC klasifikacije, izraženo u dnevno definisanim dozama (DDD) na 1000 stanovnika na dan, kao i finansijske podatke.
Za izradu izvještaja su korišćeni podaci o prometu registrovanih veledrogerija, koje su obavljale promet ljekovima u Crnoj Gori, u 2022. godini (14 privatnih i 1 državna).
Na portalu CInMED
– u dijelu Humani ljekovi/Uvoz/izvoz ljekova objavljena su sljedeća revidirana uputstva:
- Potrebna dokumentacija za izdavanje saglasnosti za uvoz ljekova koji nemaju dozvolu za stavljanje lijeka u promet i izdavanje odobrenja za uvoz/izvoz rizičnih ljekova (ažurirano 6.6.2023. godine)
- Uputstvo za popunjavanje excel tabele za uvoz ljekova koji nemaju dozvolu za stavljanje lijeka u promet (ažurirano 6.6.2023. godine)
– u dijelu Humani ljekovi/Kontrolisane supstance objavljena su sljedeća revidirana uputstva:
- Dokumentacija potrebna za izdavanje dozvole za uvoz, izvoz i tranzit droga i uputstvo za popunjavanje obrasca zahtjeva (ažurirano 6.6.2023. godine)
- Dokumentacija potrebna za izdavanje dozvole za uvoz, izvoz i tranzit prekursora i ljekova koji sadrže prekursore i uputstvo za popunjavanje obrasca zahtjeva (ažurirano 6.6.2023. godine)
– u dijelu O CInMED/Stručna mišljenja i CPP objavljena su sljedeća ažurirana uputstva:
- Dokumentacija potrebna za izdavanje stručnog mišljenja o izuzeću od odobrenog pakovanja (ažurirano 6.6.2023. godine)
- Uputstvo o načinu podnošenja zahtjeva za izdavanje CPP sertifikata (ažurirano 6.6.2023. godine)
Molimo sve podnosioce zahtjeva da se pridržavaju ažuriranih uputstava i da prilikom podnošenja zahtjeva dostavljaju dokumentaciju isključivo prema objavljenim uputstvima.
Institut za ljekove i medicinska sredstva (CInMED) bio je jedan od organizatora ovogodišnjeg Kongresa farmaceuta sa međunarodnim učešćem koji je održan od 11. do 14. maja u Budvi pod sloganom „Moć farmacije – Snaga našeg zdravlja”.
Svečanom otvaranju Kongresa prisustvovala je direktorica CInMED-a doc. dr Snežana Mugoša koja je tom prilikom pozdravila sve učesnike i podijelila entuzijazam u pogledu sticanja novih znanja, razmjene iskustava, unapređenja saradnje i novih poznanstava.
„Sigurna sam da dijelimo jedan zajednički cilj, a to je otvaranje novih vidika u obezbjeđivanju kvalitetne zdravstvene zaštite i udruživanje u borbi sa stvarnim izazovima sa kojima se svakodnevno suočavamo. A svaka staza izazova je istovremeno i nova prilika – prilika da ispišemo budućnost koja je zdravija, bezbjednija i pravednija za naše pacijente”, kazala je u svom obraćanju doc. dr Snežana Mugoša.
U okviru Kongresa održana je i sesija CInMED-a koja je bila ispraćena od strane velikog broja učesnika, a predavači su bili izuzetni eksperti u svojim oblastima. Cilj je bio da učesnicima bude pružen edukativan i inspirativan sadržaj, kao i da budu motivisani da preispitaju svoje stavove i ponašanje uz mali čas psihoterapije.
Moderator sesije bila je direktorica CInMED-a, doc. dr Snežana Mugoša. Ona je na samom početku pozdravila prisutne, a potom uputila posebnu zahvalnost svojim kolegama iz CInMED-a, kao i spoljnim ekspertima, na izuzetnom doprinosu i posvećenosti u razvoju CInMED-a u prethodnih godinu i po dana, te je u kratkim crtama prezentovala najznačajnije poduhvate.
Jedna od najznačajnijih ekspertkinja CInMED-a, prof. dr Svetlana Ibrić, koja se već drugu godinu zaredom nalazi na prestižnoj listi 2% najuticajnijh naučnika svijeta, govorila je na temu „Digitalizacija u farmaceutskoj industriji: izazovi i mogućnosti“. Kroz njeno predavanje prisutni su dobili mogućnost da zavire u budućnost i pokušaju da sagledaju šta donosi u razvoju, proizvodnji i distribuciji ljekova.
Prepoznat i priznat autoritet u oblasti farmacije i javnog zdravlja, menadžer za međunarodnu saradnju, evropske integracije i komunikacije Agencije za lekove i medicinska sredstva Srbije, mr pharm. Pavle Zelić kroz svoje inspirativno predavanje „Nema nam spasa, propasti ne možemo – sve što niste znali o infodemiji i infodemiologiji, a trebalo je da pitate“ ukazao je na vjerovatno jednu od najvećih tema javnog zdravlja, medicine i farmacije, a to je suočavanje sa dezinformacijama, teorijama zavjera i otporom prema vakcinama, kao i ostalim ljekovima, zatim medicinskim sredstvima, kliničkim ispitivanjima itd. Skrenuo je pažnju na značaj ove teme za zdravstvene radnike pa i cjelokupnu javnost na koju oni mogu da utiču kroz svoju praksu i požrtvovani rad na edukaciji pacijenata.
Mr pharm. Ana Kontek, rukovoditeljka Odsjeka za dostupnost lijekova u Agenciji za lijekove i medicinske proizvode Republike Hrvatske, govorila je o upravljanju nestašicama ljekova, te o tri osnovna segmenta u području dostupnosti ljekova koji su neophodni za očuvanje javnog zdravlja: pristup novim terapijskim mogućnostima koje primarno pokrivaju stanja za koja trenutno nije zadovoljena medicinska potreba, dostupnost lijeka i isplativost tržišta ljekova.
Mr David Kočović, rukovodilac Laboratorije u CInMED-u, predstavio je MEDI-THEFT projekat koji CInMED sprovodi zajedno sa Agencijom za ljekove Italije i drugim partnerima iz regiona i Evrope. Cilj MEDI-THEFT projekta je razvijanje platforme koja će predstavljati efikasnu podršku institucijama za izvršavanje zakona i drugim privatnim/javnim zainteresovanim stranama u suzbijanju organizovane krađe ljekova i njihove ilegalne distribucije u zvaničnom lancu snabdijevanja Evropske unije.
Direktorica međunarodne agencije Pharma Expert, odgovorna za brojna uspješna predavanja i radionice za farmaceute u različitim oblastima, doc. dr sc. Arijana Meštrović, predstavila je novi model edukacije – projekat SMART farmaceut, koji će motivisati farmaceute i unaprijediti apotekarsku praksu. Glavni imperativ je očuvati povjerenje u farmaceute.
Uvaženi i omiljeni psihijatar i psihoterapeut dr Vladimir Đurić probudio je veliko interesovanje kod prisutnih podstičući preispitivanje sopstvenih stavova i pogleda na život govoreći o značaju životne pozicije, tj. pronalaženja pravog mjesta za svoju dušu, za sreću i psihičko zdravlje.
CInMED je svojim zalaganjem dao veliki doprinos uspjehu IV Kongresa farmaceuta, a ovakvi događaji su najbolja prilika za unapređenje saradnje između institucija, razmjenu stavova i iskustava, kao i podsticanje ideja i inovacija u procesu pružanja farmaceutske zdravstvene zaštite.
Povodom Dana nezavisnosti, a u skladu sa saopštenjem izdatim od strane Ministarstva rada i socijalnog staranja, obavještavamo sve zainteresovane strane da Institut neće raditi sa strankama 22. i 23. maja 2023. godine.
Povodom Praznika rada, a u skladu sa saopštenjem izdatim od strane Ministarstva rada i socijalnog staranja, obavještavamo sve zainteresovane strane da Institut neće raditi sa strankama 1. i 2. maja 2023. godine.
Na poziv Evropske agencije za ljekove, direktorica Instituta za ljekove i medicinska sredstva (CInMED) doc. dr Snežana Mugoša i zamjenica direktora mr Mira Kontić prisustvuju 59. sastanku EMACOLEX-a koji se održava od 20. do 21. aprila u Upsali, Švedska.
EMACOLEX (European Medicines Agencies Co-operation of Legal and Legislative Issues) je tijelo Evropske agencije za ljekove, čiji su članovi pravnici država članica Evropske unije (EU) nadležni za izradu i primjenu evropskih propisa i standarda. Svrha sastanaka koje organizuje EMACOLEX jeste diskusija predstavnika u cilju postizanja dogovora o jedinstvenim načelima i pravnim stavovima koji će se primjenjivati u cijeloj evropskoj regulatornoj mreži.
Predstavnice CInMED-a ovaj sastanak ujedno vide kao idealnu priliku za razmjenu mišljenja o pravnim pitanjima i razmjenu iskustava u rješavanju pitanja od nacionalnog interesa, budući da se na ovaj način šire vidici u pogledu sistemskog uređivanja regulatornih uslova na tržištu ljekova i medicinskih sredstava.
Učešće u radu najvažnijeg pravnog tijela EU, i prije nego što Crna Gora postane država članica, od izuzetnog je značaja za dalji rad i unapređenje rada CInMED-a.
,,Moramo nastaviti da pronalazimo načine da sarađujemo i učestvujemo u radu evropskih tijela i time nadograđujemo progres institucija, ali i da pozicioniramo Crnu Goru kao ravnopravnog partnera u porodici evropskih naroda. Jedino na taj način možemo odgovoriti na stvarne izazove sa kojima se suočavamo, a naročito kada je u pitanju doprinos uspostavljanju vladavine prava i izgradnja predvidljivog i pouzdanog pravnog okvira“, poručuju iz CInMED-a.
Evropa Lek Pharma d.o.o., kao nosilac dozvole za stavljanje u promet lijeka Lorsilan (lorazepam) 2,5 mg tablete, proizvođača Belupo lijekovi i kozmetika d.d., Hrvatska, u saradnji sa Institutom za ljekove i medicinska sredstva (CInMED), sprovodi preventivno povlačenje iz prometa sledećih serija navedenog lijeka:
- serija broj 27964061 (rok upotrebe 10/2023 )
- serija broj 28624101 (rok upotrebe 08/2024)
- serija broj 21339112 (rok upotrebe 11/2025)
- serija broj 20804092 (rok upotrebe 08/2025)
- serija broj 29717032 (rok upotrebe 02/2025)
- serija broj 26824011 (rok upotrebe 10/2023)
Povlačenje se sprovodi iz preventivnih razloga, do nivoa veledrogerija i apoteka. Navedene serije lijeka povlače se na osnovu sumnje u neispravnost u kvalitetu, koja se odnosi na promjenu izgleda tablete u pojedinim pakovanjima lijeka, uočenu prilikom ispitivanja stabilnosti u dugoročnim uslovima. Nijesu utvrđeni eventualni bezbjednosni rizici povezani s navedenom neispravnošću. Od strane zdravstvenih radnika u Crnoj Gori, Institutu za ljekove i medicinska sredstva nije prijavljena sumnja na defekt kvaliteta lijeka Lorsilan 2.5 mg tablete.
Pacijentima u Crnoj Gori je dostupan lijek drugog proizvođača, koji sadrži istu aktivnu supstancu lorazepam.
Sve korisnike predmetnog lijeka upućujemo da se obrate svom ljekaru u vezi nastavka terapije.
Povodom pravoslavnog Vaskrsa, a u skladu sa saopštenjem izdatim od strane Ministarstva rada i socijalnog staranja, obavještavamo sve zainteresovane strane da Institut neće raditi sa strankama 14. i 17. aprila 2023. godine.
Obavještavamo sve korisnike usluga Instituta za ljekove i medicinska sredstva da je dana 4.4.2023. godine stupila na snagu Odluka o visini i načinu plaćanja naknada za vršenje stručnih poslova u vezi sa medicinskim sredstvima.
Povodom povlačenja serije 2710822 lijeka BCG vakcina, liofilizovana 1 mg/ml prašak i rastvarač za suspenziju za injekciju proizvođača Institut za virusologiju, vakcine i serume „Torlak“, Republika Srbija, sa tržišta Crne Gore, Institut za ljekove i medicinska sredstva obavještava stručnu i opštu javnost o sljedećem:
Institut za ljekove i medicinska sredstva je u januaru ove godine, u skladu sa Zakonom o ljekovima, odobrio uvoz ove vakcine putem tzv. interventnog uvoza, na osnovu procjene dostavljene dokumentacije kojom je dokazano da vakcina zadovoljava propisane standarde u pogledu kvaliteta, bezbjednosti i efikasnosti. Navedena dokumentacija, između ostalog, uključuje dva sertifikata o kontroli kvaliteta lijeka – Sertifikat analize proizvođača lijeka i Sertifikat analize izdat od strane Nacionalne kontrolne laboratorije Agencije za lekove i medicinska sredstva Srbije, a koja je članica Evropske mreže zvaničnih kontrolnih laboratorija za ispitivanje ljekova.
Naknadnim rutinskim ispitivanjima koja sprovodi proizvođač utvrđeno je da postoji mogućnost potencijalnog odstupanja broja živih, atenuisanih bakterija Bacillus Calmette-Guerin (Mycobacterium bovis BCG), u odnosu na deklarisani. Prema tome, očekivani imunološki odgovor može biti nepotpun kod izuzetno malog broja pacijenata (novorođenčad, djeca i odrasli sa visokim rizikom za razvoj tuberkuloze). Iz tog razloga, navedena serija vakcine je povučena, imajući u vidu da je proizvođač dužan da sprovede postupak povlačenja lijeka iz prometa, iako je u pitanju sumnja u neispravnost koja ne može da izazove ozbiljne posljedice po zdravlje ljudi.
U Institutu za ljekove i medicinska sredstva sprovodi se ekspertska misija usmjerena na implementaciju standarda i smjernica Evropske unije u postupku odobravanja i uvoza veterinarskih ljekova za tržište Crne Gore, a u cilju obezbjeđivanja kvalitetnih, bezbjednih i efikasnih ljekova za životinje.
Eksperti Evropske komisije Dr sc. vet. med. Paolo Pasquali, ekspert za javno zdravlje iz italijanskog Instituta za javno zdravlje i Prof. dr Massimo Giangaspero sa Fakulteta veterinarske medicine Univerziteta u Teramu, Italija, podijeliće svoje znanje i dugogodišnje iskustvo sa ekspertima crnogorskog Instituta u cilju unapređenja sopstvenih kapaciteta u procjeni dokumentacije za odobravanje i uvoz veterinarskih ljekova. Naime, u skladu sa svojom misijom, Institut teži da zaštiti zdravlje ljudi i životinja promocijom racionalne upotrebe ljekova, te da podrži razvoj farmaceutskog sektora kako bi stvorio uslove za veću dostupnost različitih veterinarskih ljekova, poštujući životinje, prirodu i njihovu interakciju sa čovjekom.
Na ovaj način Institut za ljekove i medicinska sredstva u fokus svog djelovanja stavlja i zdravlje i dobrobit životinja, a imajući u vidu njegov izuzetan značaj i uticaj koji ima na javno zdravlje u cjelini.
,,Uticaj bolesti životinja i mjera potrebnih za njihovo suzbijanje može biti poguban za pojedinačne životinje, populacije životinja, vlasnike životinja i privredu. Bolesti životinja koje su prenosive na ljude isto tako mogu značajno uticati na javno zdravlje. Stoga moramo imati na raspolaganju dovoljno kvalitetnih i efikasnih veterinarskih ljekova kako bi se osigurali visoki standardi zdravlja životinja i javnog zdravlja i razvoj sektora poljoprivrede i veterine“ – poručuju iz Instituta za ljekove i medicinska sredstva.
Navedeni projekat je samo jedan od strateških koraka u unapređenju polja veterinarskih ljekova, te iz Instituta za ljekove i medicinska sredstva očekuju sprovođenje daljih koraka kroz opsežnije aktivnosti koje omogućavaju Evropska komisija i Evropska agencija za ljekove, duboko svjesni činjenice da čuvajući zdravlje životinja čuvamo zdravlje ljudi i životnu sredinu.
Na portalu CInMED u dijelu Humani ljekovi / Izdavanje dozvole za lijek, objavljeno je revidirano uputstvo Način podnošenja zahtjeva i dokumentacije za prenos dozvole za lijek na drugog nosioca dozvole za lijek, i obrasci zahtjeva za prenos dozvole na novog nosioca dozvole, prestanak važenja dozvole za stavljanje lijeka u promet i obavještenje o stavljanju lijeka u promet.
Ista dokumenta su objavljena i u dijelu Veterinarski ljekovi / Izdavanje dozvole za lijek.
Na portalu CInMED u dijelu Humani ljekovi – Izdavanje dozvole za lijek, objavljeni su revidirani obrasci za SmPC i PL. U obrasce je uvršten QR kod za online prijavu sumnje na neželjeno dejstvo lijeka.
Molimo podnosioce zahtjeva da ubuduće koriste ažurirane obrasce.
Direktorica Instituta za ljekove i medicinska sredstva (CInMED) Doc. dr med. spec. Snežana Mugoša i zamjenica direktora Mr Mira Kontić boravile su u zvaničnoj posjeti Agenciji za ljekove Malte (Malta Medicines Authority – MMA). Na sastancima sa direktorom Prof. dr Entonijem Seraćino Inglotom, kao i rukovodiocima MMA razmotrene su mogućnosti za saradnju, razmjenu znanja i iskustava, kao i zajedničke aktivnosti i projekte. Zaključeno je da su prilike za uspješnu saradnju raznovrsne, te da će brojne sličnosti između ovih institucija, ali i Crne Gore i Malte, doprinijeti izgradnji stabilnog i plodonosnog partnerskog odnosa.
Ovo je samo jedan u nizu koraka koje je CInMED preduzeo u prethodnih godinu dana u cilju jačanja saradnje i partnerskih odnosa sa eminentnim institucijama Evrope, što predstavlja izvanrednu osnovu za dalji razvoj CInMED-a, kao i ključni preduslov za njegovo afirmisanje na nivou Evropske unije, ali i na međunarodnom planu.
Uspješni pregovori rezultirali su potpisivanjem Sporazuma o saradnji između CInMED-a i MMA, kome je prisustvovao resorni ministar Malte Dr Džo Etijen Abela, kao i brojni mediji.
Tom prilikom direktorica CInMED-a, dr Mugoša, izrazila je zahvalnost resornom ministru Malte, kao i direktoru MMA, na ukazanom povjerenju i nesebičnoj podršci.
„Bila nam je neizmjerna čast i zadovoljstvo što smo imali priliku da posjetimo vašu predivnu zemlju i da steknemo brojna, za našu instituciju značajna, poznanstva i uspostavimo kontakte. Zahvaljujem vam na gostoprimstvu i prilici da vam predstavim Institut za ljekove i medicinska sredstva Crne Gore, naša dostignuća i planove za budućnost. Izuzetno nam je drago što smo mogli da steknemo uvid u rad, iskustva i unutrašnju organizaciju MMA. Kao jedna od najboljih malih agencija za ljekove u Evropi, a po brojnim aspektima slična nama, MMA će nam biti uzor i saputnik na putu prema Evropskoj uniji. Uspostavljanje partnerskog odnosa sa vama je od izuzetnog značaja za Institut za ljekove i medicinska sredstva Crne Gore i umnogome će doprinijeti uključivanju Instituta u evropsku porodicu regulatora. Uvjerena sam da će ovo biti izuzetno uspješna saradnja i radujem se novim susretima, iskustvima, saznanjima, a prije svega prijateljstvu“, izjavila je dr Mugoša
Ministar Abela: Malta pouzdan prijatelj Crne Gore na evropskom putu
Resorni ministar Malte, Dr Džo Etijen Abela kazao je da će MMA imati ulogu mentora i oslonca na putu Crne Gore ka primjeni standarda uspostavljenih od strane Evropske komisije, te da su ti standardi značajan dio kriterijuma koje Crna Gora treba da zadovolji kako bi što je ranije moguće postala dio Evropske unije.
„Potpisivanjem sporazuma od strane ove dvije instutucije napravljen je temelj za mnogo šire okvire saradnje, ne samo na nivou samih institucija, već i na nivou država, posebno u oblastima zdravstva i nauke. Dakle, posjetom direktorice CInMED-a, dr Mugoše, iniciran je čitav spektar ideja za buduću saradnju, ne samo u regulatornom kontekstu, već i u kontekstu zaštite javnog zdravlja i unapređenja obrazovanja“, istakao je ministar Abela.
Direktor MMA, Prof. dr Entoni Seraćino Inglot rekao je da smatra da će ova saradnja biti vrlo produktivna, te da će na ovaj način biti olakšana razmjena iskustava, kao i da će eksperti ove dvije institucije imati priliku da uče jedni od drugih.
„Budući da obje naše institucije imaju mali broj eksperata, ovo partnerstvo će kroz međusobnu podršku poduprijeti naše napore da tržišta Malte i Crne Gore budu uređena u smislu kvalitetnih, bezbjednih i efikasnih ljekova“. Posebno inspirativnim smatra dalekosežne i raznovrsne mogućnosti ove saradnje utemeljene, kako navodi, na činjenici da se ove dvije institucije podudaraju u brojnim segmentima. „Imajući u vidu da je i MMA nastavna baza fakulteta i naučna institucija, prilike za saradnju su raznolike, u smislu da povlastice razmjene kadrova neće biti ograničene na stručno usavršavanje, već će biti proširene i na naučni razvoj, kao i unapređenje obrazovanja“, zaključuje profesor Inglot.
Dr Mugoša ovaj novi vid partnerstva vidi kao novu priliku za sticanje znanja, prepoznavanje i implementaciju savremenih modela poslovanja i organizacije rada, kao i razvijanje i oblikovanje stručnosti eksperata CInMED-a.
„Ostajemo dosljedni svom cilju da iskoristimo, ali i da stvorimo prilike za učenje i razvijanje u svim aspektima. Veoma smo svjesni svoje uloge i odgovornosti u zdravstvenom sistemu i ozbiljno im pristupamo, te se vodimo imperativom da ne postavljamo granice unapređivanju znanja, obrazovanja, kompetencija i vještina, kako metodoloških, tako i socijalnih“, navodi dr Mugoša.
Sporazum sa Agencijom za ljekove Malte je proistekao kao nastavak saradnje koju je započela i utemeljila delegacija Vlade Crne Gore na čelu sa ministrom zdravlja Dragoslavom Šćekićem, tokom posjete Malti u novembru prošle godine. Sporazum će omogućiti dvijema institucijama da uspostave saradnju, ali će istovremeno dodatno učvrstiti odnose dvije prijateljske zemlje.
Na portalu CInMED u dijelu Medicinska sredstva – Promet na veliko – Interventni uvoz, objavljeni su revidirani Obrazac zahtjeva za izdavanje odobrenja za uvoz medicinskih sredstava koja nijesu registrovana i Obrazloženi predlog / izjava predlagača za uvoz medicinskih sredstava koja nijesu registrovana.
Molimo podnosioce zahtjeva da prilikom podnošenja zahtjeva za izdavanje odobrenja za uvoz medicinskih sredstava koja nijesu registrovana, za zahtjeve predate nakon 24.1.2023. godine, obavezno koriste ažurirane obrasce.
Povodom sve većeg interesovanja građana za sastav vakcina, te njihovu bezbjednost i djelotvornost, Institut za ljekove i medicinska sredstva (CInMED) podsjeća javnost da se sastav, proizvodnja, distribucija i primjena svih vakcina u Crnoj Gori strogo kontrolišu, i to u skladu sa najvišim evropskim i međunarodnim standardima.
Upravo zbog činjenice da se vakcine primjenjuju kod zdravih ljudi, najčešće kod djece, sa ciljem zaštite od zaraznih bolesti, posebna pažnja je posvećena poštovanju najviših standarda pri svakom koraku njihove proizvodnje, distribucije i primjene. U sastav vakcina ulaze supstance koje imaju poznato djelovanje, koje odgovaraju međunarodnim standardima kvaliteta, a zastupljene su u količinama koje dokazano nemaju štetan učinak na zdravlje ljudi. Prije stavljanja u promet, djelotvornost i bezbjednost vakcine mora biti dokazana kroz brojne pretkliničke i kliničke studije.
U Crnoj Gori su u prometu vakcine koje se koriste u zemljama Evropske unije i zemljama okruženja, a svaku seriju vakcine (bez obzira na to da li je ona registrovana u Crnoj Gori ili je u prometu na osnovu saglasnosti za tzv. interventni uvoz) prilikom uvoza u Crnu Goru obavezno prati sertifikat proizvođača, kao i dodatni sertifikat jedne od nezavisnih akreditovanih laboratorija, koji potvrđuje odgovarajući kvalitet. Bezbjednost primjene vakcina, kao i ostalih ljekova u prometu, CInMED prati kroz aktivno učešće i međunarodnu saradnju u okviru internacionalnog programa praćenja bezbjednosti primjene ljekova. Dodatno, bezbjednost vakcina u prometu se budno prati kroz sistem nadzora nad imunizacijom, koji zajednički vrše CInMED i Institut za javno zdravlje, kako bi svaki eventualni problem u vezi sa primjenom vakcina bio uočen što je moguće ranije, a reakcija institucija bila blagovremena i adekvatna.
Na portalu CInMED (www.cinmed.me), pretragom Registra ljekova, zdravstveni radnici i pacijenti mogu pronaći tačne i pouzdane informacije o vakcinama koje su registrovane u Crnoj Gori. Dostupni su Sažetak karakteristika lijeka (namijenjen zdravstvenim radnicima) i Uputstvo za lijek (namijenjeno pacijentima), koje CInMED odobrava prilikom registracije lijeka, a koji sadrže informacije o sastavu lijeka, načinu njegovog djelovanja, odobrenim indikacijama, kao i mogućim neželjenim reakcijama.
CInMED poziva pacijente da odluke o svom zdravlju i zdravlju svoje djece donose na osnovu pouzdanih i na dokazima zasnovanih informacija o vakcinama, u saradnji sa svojim izabranim doktorom i pedijatrom.
Na portalu CInMED u dijelu Humani, odnosno Vetarinarski ljekovi, u djelovima Izdavanje dozvole za lijek, objavljen je revidiran obrazac zahtjeva za izdavanje dozvole za stavljanje lijeka u promet.
Molimo podnosioce zahtjeva da prilikom podnošenja zahtjeva za izdavanje dozvole za lijek, za zahtjeve predate nakon 01.01.2023. godine, koriste ažurirani obrazac.
Povodom predstojećih novogodišnjih i božićnih praznika, a u skladu sa saopštenjem izdatim od strane Ministarstva rada i socijalnog staranja, obavještavamo sve zainteresovane strane da Institut neće raditi sa strankama 2, 3. i 6. januara 2023. godine.
Komitet za procjenu rizika (Pharmacovigilance Risk Assessment Committee, PRAC) Evropske agencije za ljekove (European Medicines Agency, EMA) je preporučio ukidanje dozvole za stavljanje u promet ljekova koji sadrže aktivnu supstancu folkodin, u zemljama Evropske unije (EU).
Povodom navedenog obavještenja, Institut za ljekove i medicinska sredstva (CInMED) obavještava stručnu i opštu javnost da u Crnoj Gori nije izdata dozvola za stavljanje u promet nijednog lijeka koji sadrži aktivnu supstancu folkodin. Pored toga, nakon 2016. godine nije odobren nijedan uvoz lijeka za koji nije izdata dozvola za stavljanje u promet (neregistrovani lijek), a koji sadrži folkodin kao aktivnu supstancu.
Folkodin je lijek koji se dugi niz godina koristi u liječenju suvog kašlja, kod djece i odraslih. Ranije je u prometu u Crnoj Gori bio pod nazivom Pholcodin, kapsula, 10mg, Pholcodin sirup, 4mg/5ml i Pholcodin sirup 5mg/5ml, proizvođača Alkaloid AD Skopje. CInMED nije primio nijednu prijavu sumnje na neželjeno dejstvo navedenih ljekova.
Prilikom procjene bezbjednosti primjene ljekova koji sadrže folkodin, PRAC je analizirao sve dostupne podatke, uključujući i rezultate nedavno sprovedene ALPHO studije. Dostupni podaci su pokazali da je primjena folkodina u periodu od 12 mjeseci prije opšte anestezije, sprovedene uz primjenu neuromuskularnih blokatora, povezana sa rizikom od razvoja anafilaktičke reakcije (teška alergijska reakcija koja ugrožava život). Kako nije bilo moguće identifikovati mjere kojima bi se ovaj rizik umanjio, niti grupu pacijenata za koju korist od primjene folkodina prevazilazi rizike, preporučeno je povlačenje ovog lijeka iz prometa. Preporuka PRAC će biti proslijeđena Koordinacionoj grupi za postupak međusobnog priznavanja i decentralizovani postupak za humane ljekove (CMDh) EMA, koja će svoju odluku proslijediti Evropskoj komisiji, čija je odluka pravno obavezujuća za sve zemlje članice EU.














